sexta-feira, 26 de agosto de 2016
quinta-feira, 18 de agosto de 2016
Átomo
O átomo é a menor partícula capaz de identificar um elemento químico e participar de uma reação química.
O estudo do átomo se iniciou na Grécia antiga com o filósofo Leucipo e seu discípulo Demócrito: para eles, o átomo era o menor componente de toda a matéria existente. Sendo, então, impossível dividi-lo em partes menores.
Ao desenrolar da história, diversos cientistas e estudiosos tentaram definir o átomo quanto a sua forma, dando origem a diversas teorias sobre sua constituição física. Surgiram, então, os modelos atômicos.
Modelos Atômicos
Modelo de Dalton (bola de bilhar) - 1803
Para John Dalton, a teoria de Leucipo e Demócrito era bastante coerente. Segundo este modelo, os átomos eram as menores partículas possíveis, assumiam formas esféricas e possuíam massa semelhante caso fossem correspondentes ao mesmo elemento químico.
Modelo de Thomson (pudim de passas) – 1897
Através da descoberta do elétron (partícula constituinte do átomo com carga elétrica negativa), o modelo de Dalton ficou defasado. Assim, com os estudos de Thomson, um novo modelo foi idealizado.
De acordo com este novo modelo, o átomo era uma esfera de carga elétrica positiva incrustada com elétrons, com carga negativa, tornando-se assim eletricamente neutro. Ficou conhecido como pudim de passas.
Modelo de Rutherford-Bohr (sistema planetário) – 1908/1910
Rutherford ao bombardear partículas alfa sobre uma lâmina de ouro percebeu que a maioria atravessava a lâmina. Enquanto que uma menor parte sofria pequeno desvio, e uma parte ínfima sofria grande desvio contrário à trajetória.
A partir desse experimento, foi possível perceber que os átomos não eram maciços como se pensava, mas dotados de grande espaço vazio. Assim como, que eram constituídos por um núcleo carregado positivamente e uma nuvem eletrônica carregada negativamente. Essa nuvem eletrônica era composta por elétrons que giravam em órbitas elípticas ao redor do núcleo (assim como os planetas ao redor do sol).
Também constatou-se que a maior parte da massa de um átomo se concentra no núcleo (que rebatia as partículas alfa no sentido contrário do bombardeio).
O Fósforo
O fósforo não é a cabeça do palito, mas a superfície áspera da caixa, que contém fósforo vermelho (uma das mais seguras maneiras de se usar o fósforo), sulfeto de antimônio (Sb2S3), trióxido de ferro ( Fe2O3) e goma arábica (cola). O palito é o clorato de potássio (KClO3) e não como muitas pessoas pensam que a pólvora.
Mas então por que colocar esse nome: Palito de Fósforo? Durante muito tempo, o fósforo foi realmente colocado no palito e acendia em qualquer superfície áspera. Na verdade, este tipo de palito ainda está lá, é tradicionalmente encontrado no Reino Unido.
A descoberta do fósforo
O palito de fósforo foi inventado no século XIX, porém a história do palito que mudou a forma de se fazer fogo se iniciou bem antes, em 1669, com a descoberta do fósforo (elemento químico P).
O palito de fósforo foi inventado no século XIX, porém a história do palito que mudou a forma de se fazer fogo se iniciou bem antes, em 1669, com a descoberta do fósforo (elemento químico P).
O alemão Hennig Brand, em suas tentativas de transformar metais em ouro, descobriu acidentalmente o elemento ao estudar amostras de urina. O material que obteve brilhava e, por essa razão, Brand batizou a substância de Phosphoros, que quer dizer “aquele que traz a luz, que ilumina”.
Em 1680, o britânico cientista Robert Boyle, um dos mentores e fundadores da química atual, observou que uma chama era gerada ao gerar atrito entre um pedaço de papel com fósforo em um pedaço de madeira coberto com enxofre.
Boyle acreditava que o fogo não era provocado apenas pela atrito, mas por algo próprio àquelas substâncias. E estava certo, tinha descoberto o princípio que levaria à invenção do fósforo.
Depois da descoberta, vários aparatos químicos para gerar fogo foram desenvolvidos na Europa. Alguns usavam a descoberta de Boyle, outros, hidrogênio, porém eram todos complicados e arriscados. Em 1805, um químico francês chamado K. Chancel criou um palito coberto de clorato de potássio e açúcar. Mas, como era preciso encharcá-lo em ácido sulfúrico para que queimasse, ele não fez muita fama.
Em 1827, o farmacêutico inglês John Walker descobriu que se combinasse, na ponta de um palito, sulfeto de antimônio, clorato de potássio, cola e amido, ele poderia ser aceso por atrito em qualquer superfície arida. Walker chamou os seus palitos de congreves, numa citação aos foguetes bélicos inventados por William Congreve em 1808.
Apesar do apoio de amigos, Walker decidiu não patentear sua invenção, registro que dá direitos exclusivos ao criador, pois desejava que ela fosse um bem público. Por isso, muitas pessoas a replicaram, inclusive Samuel Jones, que começou a vender os palitos com o nome de Lucifers (um dos nomes dados ao diabo).
Embora cheirasse mau e fossem perigosos (eram explosivos e às vezes acendiam sozinhos dentro da própria embalagem), os Lucifers ficaram muito famosos entre fumantes. Para evitar acidentes, os primeiros palitos eram carregados em estojos de metais ou de porcelana. Os mais finos eram feitos de ouro e prata e eram trabalhados como uma jóia.
Do que é feito o plástico
Você sabe como é feito o plástico? A principal matéria-prima deste produto é o petróleo, combustível natural não renovável, bastante empregado pelo homem em atividades diversas e que está diretamente relacionado à poluição ambiental.
No processo de fabricação do plástico convencional, o petróleo é transformado em resina plástica. As resinas passam por processos específicos, que dependem do tipo de plástico que se deseja fabricar. A composição química do petróleo é modificada para que o homem tenha à disposição diferentes tipos de materiais para a produção de plásticos transparentes e coloridos.
Os plásticos mais empregados são aqueles que recebem o nome de termoplásticos, ou seja, que ficam moles quando passam por aquecimento e podem ser transformados em diversos tipos de produtos.
Nós mantemos contato com o plástico diariamente, tanto em garrafas pets, utensílios de cozinha, sacolas de supermercado, brinquedos e outros objetos. Cerca de 4% do petróleo utilizado no Brasil segue para o setor de produção de plástico.
O excesso de plástico acumulado no planeta é muito prejudicial à natureza, pois o plástico não se decompõe com facilidade, podendo ficar no meio ambiente por até 400 anos. Para tentar minimizar os efeitos negativos desse produto, foram criadas alternativas como o plástico biodegradável, que é capaz de se decompor.
É importante que a população tenha consciência de que os objetos e embalagens plásticas devem ser separados corretamente na Coleta Seletiva, a fim de serem encaminhados para a reciclagem e reempregados para a fabricação de novos produtos. Essa é a única maneira de evitar a poluição causada ao ambiente por essa matéria-prima.
No processo de fabricação do plástico convencional, o petróleo é transformado em resina plástica. As resinas passam por processos específicos, que dependem do tipo de plástico que se deseja fabricar. A composição química do petróleo é modificada para que o homem tenha à disposição diferentes tipos de materiais para a produção de plásticos transparentes e coloridos.
Os plásticos mais empregados são aqueles que recebem o nome de termoplásticos, ou seja, que ficam moles quando passam por aquecimento e podem ser transformados em diversos tipos de produtos.
Nós mantemos contato com o plástico diariamente, tanto em garrafas pets, utensílios de cozinha, sacolas de supermercado, brinquedos e outros objetos. Cerca de 4% do petróleo utilizado no Brasil segue para o setor de produção de plástico.
O excesso de plástico acumulado no planeta é muito prejudicial à natureza, pois o plástico não se decompõe com facilidade, podendo ficar no meio ambiente por até 400 anos. Para tentar minimizar os efeitos negativos desse produto, foram criadas alternativas como o plástico biodegradável, que é capaz de se decompor.
É importante que a população tenha consciência de que os objetos e embalagens plásticas devem ser separados corretamente na Coleta Seletiva, a fim de serem encaminhados para a reciclagem e reempregados para a fabricação de novos produtos. Essa é a única maneira de evitar a poluição causada ao ambiente por essa matéria-prima.
Reações Químicas
Uma reação química ocorre quando certas substâncias sofrem transformações em relação ao seu estado inicial (reagentes). Para que isso possa acontecer, as ligações entre átomos e moléculas devem ser rompidas e devem ser restabelecidas de outra maneira. Como essas ligações podem ser muito fortes, geralmente é necessária energia na forma de calor para iniciar a reação.
A ocorrência de uma reação química é indicada pelo aparecimento de novas substâncias (produtos), diferentes das originais (reagentes). Quando as substâncias reagem, às vezes ocorrem fatos visíveis que confirmam a ocorrência da reação. Dentre eles, podemos destacar: desprendimento de gás e luz, mudança de coloração e cheiro, formação de precipitados, etc.
Em certas situações, os reagentes se encontram com impurezas e as reações químicas não acontecem com aproveitamento total porque não ocorrem somente nos laboratórios, mas em toda a parte e a todo o momento. Oxidação e redução são exemplos desses tipos de reações que ocorrem em nosso dia a dia.
Quando dois reagentes são misturados e eles não se encontram em proporções iguais, um deles será consumido totalmente enquanto o outro poderá deixar certa quantidade sem reagir. O reagente que teve seu aproveitamento total é chamado de reagente limitante e o outro será o reagente em excesso.
Um exemplo de reação química muito comum em nosso cotidiano é a reação de combustão, para que ela ocorra é necessária a presença de três fatores: um combustível, um comburente e energia de ativação. Essa reação consiste na queima de um combustível que pode ser a gasolina, o álcool, etc., através da energia de ativação (calor de uma chama, faísca elétrica), na presença de um comburente que, em geral, é o oxigênio do ar (O2).
A ocorrência de uma reação química é indicada pelo aparecimento de novas substâncias (produtos), diferentes das originais (reagentes). Quando as substâncias reagem, às vezes ocorrem fatos visíveis que confirmam a ocorrência da reação. Dentre eles, podemos destacar: desprendimento de gás e luz, mudança de coloração e cheiro, formação de precipitados, etc.
Em certas situações, os reagentes se encontram com impurezas e as reações químicas não acontecem com aproveitamento total porque não ocorrem somente nos laboratórios, mas em toda a parte e a todo o momento. Oxidação e redução são exemplos desses tipos de reações que ocorrem em nosso dia a dia.
Quando dois reagentes são misturados e eles não se encontram em proporções iguais, um deles será consumido totalmente enquanto o outro poderá deixar certa quantidade sem reagir. O reagente que teve seu aproveitamento total é chamado de reagente limitante e o outro será o reagente em excesso.
Um exemplo de reação química muito comum em nosso cotidiano é a reação de combustão, para que ela ocorra é necessária a presença de três fatores: um combustível, um comburente e energia de ativação. Essa reação consiste na queima de um combustível que pode ser a gasolina, o álcool, etc., através da energia de ativação (calor de uma chama, faísca elétrica), na presença de um comburente que, em geral, é o oxigênio do ar (O2).
Radioatividade
A radioatividade é um termo químico que causa muita desconfiança e pavor em muitas pessoas, isso se deve ao que ela ocasionou em certas situações como por exemplo os diversos acidentes nucleares, sendo o mais conhecido o de Chernobyl. Porém, este não é um fenômeno ruim, também pelo fato de suas diversas aplicações em nosso dia a dia que possibilitaram entre outras coisas o avanço de tratamentos como o da radioterapia.
As partículas emitidas por um elemento radioativo podem ser de três tipos: Alfa (α), Beta (β) eGama (γ).Um elemento químico radioativo é aquele que é capaz de emitir radiações fortes a ponto de por exemplo produzir a fluorescência. O fenômeno de emissão ocorre quando o átomo se encontra com excesso de partículas e/ou cargas precisando assim liberar energia na forma de radiação para se estabilizar. A radioatividade pode ser espontânea ou induzida, a primeira é um processo natural e que ocorre em elementos e seus isótopos encontrados naturalmente, já o segundo caso se trata de um processo artificial provocado por transformações nucleares, geralmente em reatores.
- Partícula alfa: são partículas positivas constituídas por dois prótons e dois nêutrons; não possui um alto poder de penetração. Esta partícula pode ser também chamada de núcleo deHélio (He) por ter a mesma quantidade de prótons e nêutrons deste gás nobre.
- Partícula beta: são partículas negativas constituídas por um elétron. Quando há excesso de carga negativa é liberada uma partícula beta negativa e quando há excesso de cargas positivas é liberado um pósitron ou partícula beta positiva. Seu poder penetrante é maior que o da alfa e menor que o da gama.
- Partícula gama: é emitida quando mesmo após a emissão das alfa e beta ainda existam cargas a serem estabilizadas no núcleo atômico, sendo esse excesso liberado em forma de ondas eletromagnéticas. Este tipo de partícula pode atingir as nossas células sendo utilizada para esterilização de equipamentos médicos por exemplo. Sua capacidade de penetração é, portanto, maior do que todas as outras formas de partículas. Esta radiação é de natureza eletromagnética e portanto, não precisa de um meio material para se propagar. Alguns tratamentos para o câncer como a teleterapia utilizam este tipo de radiação e tem como efeito a diminuição da replicação das células malignas.
Descoberta da radioatividade
A radioatividade teve seu início como fato científico quando Henry Becquerel em 1896 depositou um sal de Urânio sobre uma lâmina fotográfica e após certo tempo notou que o mesmo havia deixado a marca das suas radiações emitidas nesta chapa. A partir disso, esse fenômeno causou curiosidade em diversos cientistas entre eles Marie Curie e Pierre Curie, um casal de químicos que trabalhava nos laboratórios de Becquerel. Em 1898, Marie Curie descobriu um elemento muito mais radioativo que o Urânio e o nomeou de acordo com seu país natal, era o Polônio. Após isso foi descoberto pelo casal Curie outro elemento ainda mais radioativo e então o chamaram de Rádio.
Em seguida, Ernest Rutherford descobriu as radiações alfa e beta o que contribuiu para a explicação do seu modelo atômico (conhecido como planetário) e também para os avanços nos estudos dos compostos radioativos. Em 1939 Enrico Fermi constatou que nêutrons liberados na desintegração de Urânio-235 incidiam em átomos vizinhos ocasionando desintegrações sucessivas, desta forma seriam possíveis reações em cadeia possibilitando assim a produção em grande escala da energia nuclear.
Em 1942 foi construído nos EUA o primeiro reator de Urânio-235 que foi utilizado também para a construção das bombas atômicas que atingiram primeiro Hiroshima e depois Nagasaki causando milhares de mortes. Após isso diversos outros acidentes foram ocasionados como o de Chernobyl e o do césio-137 em Goiânia.
Aplicações da radioatividade
Porém, como já citamos as radiações são também utilizadas para inúmeros benefícios como por exemplo: o exame de Raio-X, a cintilografia, que é um processo onde radioisótopos são usados para exames com imagens em alguns órgãos onde resultados são obtidos através do contraste. Outro exemplo é a radioterapia que muitas vezes se torna essencial para o tratamento do câncer e é um processo onde se utiliza o Césio-137. Além disso usinas nucleares são construídas para geração de energia limpa, ou seja, que não emite gases poluentes. Porém sobre essas ações entram diversos debates éticos questionando até que ponto isso seria realmente bom.
No Brasil temos as Usinas Angra 1, 2 e 3. Estão localizadas em Angra dos Reis, Rio de Janeiro. A primeira começou a funcionar em 1984 e é operada pela Eletrobras Eletronuclear. As outras estão em operação e construção respectivamente.
Mas a pergunta que nos fazemos é para onde vão os resíduos radioativos? Esses resíduos radioativos são também chamados de lixo atômico e são extremamente perigosos para todos os seres vivos. Existe a Agência Internacional de Energia Atômica que regula o destino desses rejeitos que são classificados em: baixa atividade, média atividade, alta vida média ou são desclassificados. Esses resíduos são armazenados em cilindros enormes feitos de aço e chumbo. Quando são de baixa ou média atividade geralmente são armazenados em cilindros subterrâneos. Quando são de alta vida média ou alta atividade sofrem armazenamento geológico, ou seja, em grandes profundidades. Porém não se sabe se esse armazenamento seria efetivo a longo prazo o que causa polêmica acerca do assunto.
O contato com substâncias radioativas em grandes quantidades pode alterar o sistema biológico e além disso pode ser letal. Isto ocorre devido a destruição do sistema imunológico por parte da radiação. O câncer é uma das doenças mais associadas à exposição a radiação porque ela pode alterar o processo de formação e divisão das células. Outros sintomas após a exposição são as náuseas, as queimaduras na pele e as queimaduras internas.
Polaridade das moléculas
MOLÉCULAS APOLARES
Na ligação covalente entre dois átomos, os elétrons compartilhados são atraídos simultaneamente pelos dois núcleos atômicos. Quando a molécula for diatômica, formada por átomos do mesmo elemento químico (H2 , O2 , N2 , etc.), ou seja, com a mesma eletronegatividade, eles irão atrair os elétrons envolvidos na ligação com a mesma intensidade, havendo uma distribuição de cargas homogênea, sem formação de polos. Esta molécula é denominada molécula apolar. Se a molécula for formada por três átomos ou mais, teremos que analisar cada ligação, pois uma molécula pode apresentar ligações polares e, mesmo assim, ser apolar. A soma dos vetores de cada ligação polar é o vetor chamado momento dipolar resultante. As ligações apolares possuem momento dipolar resultante nulo (igual a zero).
MOLÉCULAS POLARES
Se os átomos envolvidos na ligação forem de elementos diferentes, o átomo do elemento mais eletronegativo atrairá mais intensamente os elétrons da ligação para si, ficando, então, com uma carga parcial negativa, e o átomo menos eletronegativo com carga parcial positiva. Esse fato caracteriza a molécula como polar. Nas moléculas com mais de dois átomos, para que a molécula seja polar, a soma dos vetores das ligações deve ser diferente de zero.
Na ligação covalente entre dois átomos, os elétrons compartilhados são atraídos simultaneamente pelos dois núcleos atômicos. Quando a molécula for diatômica, formada por átomos do mesmo elemento químico (
MOLÉCULAS POLARES
Se os átomos envolvidos na ligação forem de elementos diferentes, o átomo do elemento mais eletronegativo atrairá mais intensamente os elétrons da ligação para si, ficando, então, com uma carga parcial negativa, e o átomo menos eletronegativo com carga parcial positiva. Esse fato caracteriza a molécula como polar. Nas moléculas com mais de dois átomos, para que a molécula seja polar, a soma dos vetores das ligações deve ser diferente de zero.
forças intermoleculares
As forças intermoleculares são aquelas responsáveis por manter moléculas unidas na formação dos diferentes compostos, elas se classificam em:
Força dipolo-induzido: é causada pelo acúmulo de elétrons em determinada região da molécula.
As interações intermoleculares presentes nas moléculas apolares são as dipolo-induzido, mas não ocorrem o tempo todo, a distribuição de elétrons na eletrosfera dessas moléculas é uniforme. Contudo, em algum instante ocorre um acúmulo de cargas δ + e δ- (pólos) nas extremidades, é aí que as forças dipolo-induzido aparecem, e como o próprio nome já diz, elas induzem as moléculas vizinhas a também entrarem em desequilíbrio.
Veja exemplos de compostos apolares cujas moléculas interagem através de forças dipolo-induzido:
Cl2, CO2, CH4, H2, O2
Forças dipolo-dipolo: força intermolecular presente em compostos polares.
Exemplos de compostos polares em que ocorre interação dipolo-dipolo:
H2S, CO, SO2, HCl
Ligações de hidrogênio: essa é a interação mais forte que ocorre entre moléculas, é comparada à força dipolo-dipolo bem mais intensificada. Esta ligação ocorre entre moléculas que contêm átomos de hidrogênio ligados a átomos de nitrogênio, flúor, oxigênio, ou seja, elementos muito eletronegativos, por isso os pólos δ + e δ- ficam mais acentuados.
A molécula de água é um exemplo clássico das ligações de hidrogênio, onde átomos de H se unem fortemente aos átomos de H de outras moléculas para formar a cadeia de H20.
Força dipolo-induzido: é causada pelo acúmulo de elétrons em determinada região da molécula.
As interações intermoleculares presentes nas moléculas apolares são as dipolo-induzido, mas não ocorrem o tempo todo, a distribuição de elétrons na eletrosfera dessas moléculas é uniforme. Contudo, em algum instante ocorre um acúmulo de cargas δ + e δ- (pólos) nas extremidades, é aí que as forças dipolo-induzido aparecem, e como o próprio nome já diz, elas induzem as moléculas vizinhas a também entrarem em desequilíbrio.
Veja exemplos de compostos apolares cujas moléculas interagem através de forças dipolo-induzido:
Cl2, CO2, CH4, H2, O2
Forças dipolo-dipolo: força intermolecular presente em compostos polares.
Exemplos de compostos polares em que ocorre interação dipolo-dipolo:
H2S, CO, SO2, HCl
Ligações de hidrogênio: essa é a interação mais forte que ocorre entre moléculas, é comparada à força dipolo-dipolo bem mais intensificada. Esta ligação ocorre entre moléculas que contêm átomos de hidrogênio ligados a átomos de nitrogênio, flúor, oxigênio, ou seja, elementos muito eletronegativos, por isso os pólos δ + e δ- ficam mais acentuados.
A molécula de água é um exemplo clássico das ligações de hidrogênio, onde átomos de H se unem fortemente aos átomos de H de outras moléculas para formar a cadeia de H20.
Ligação Química
Como o próprio nome indica, é a ligação química entre os átomos de metais. Qualquer porção de metal é formada por um número enorme de átomos dispostos de maneira organizada.
Os metais apresentam baixa energia de ionização e alta eletropositividade, ou seja, grande facilidade em perder elétrons da camada de valência. Assim, na ligação metálica, os átomos perdem elétrons dessa, formando cátions.
Forma-se uma quantidade muito grande de cátions envolvidos por uma quantidade enorme de elétrons livres. Dizemos que os cátions estão envolvidos por um "mar de elétrons".
A ligação metálica ocorre pela atração elétrica entre os cátions (íons positivos) e os elétrons livres. Esta atração é muito intensa, o que garante o estado sólido dos metais nas condições ambiente, exceto no caso do mercúrio, o único metal líquido.
O aglomerado organizado de cátions que se forma na ligação metálica é chamado de retículo cristalino metálico.
Em qualquer porção de metal, a quantidade de átomos do metal envolvido é muito grande e indeterminada. Representação: num pedaço de ferro, por exemplo, teríamos Fen; num pedaço de ouro, Aun, mas por uma questão de simplificação, utiliza-se apenas o símbolo do metal: Fe, Au, etc.
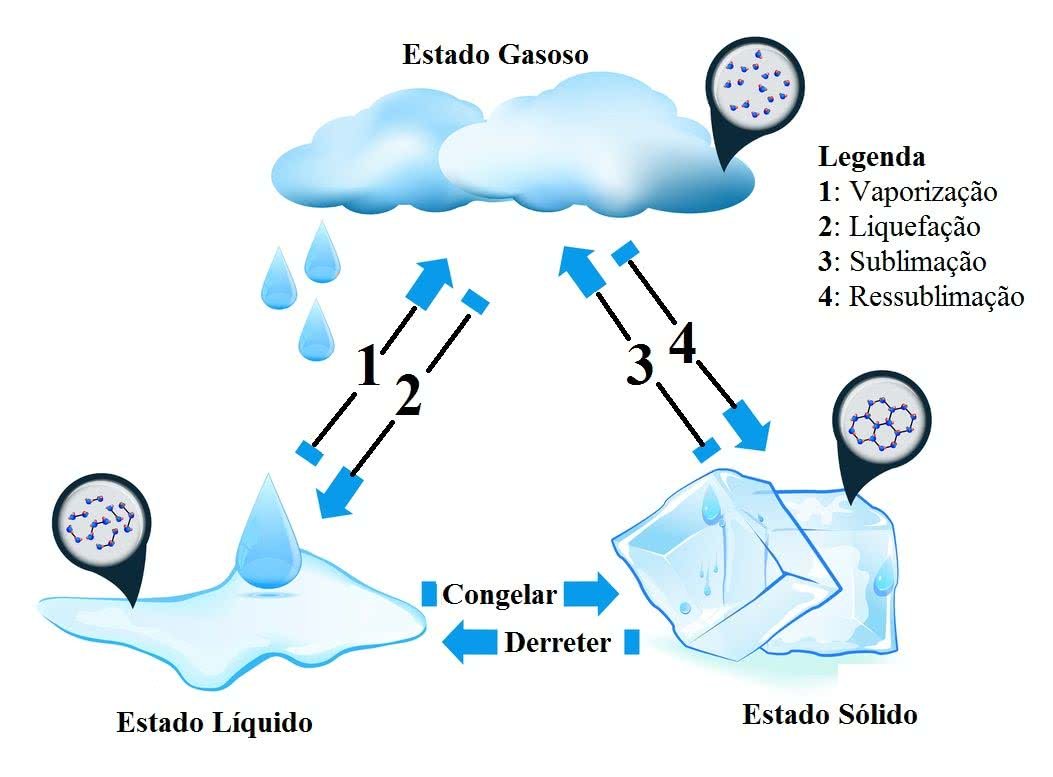
Estados Físicos da Água
A água é encontrada na natureza em três estados físicos, a saber: Líquido, Sólido e Gasoso. Assim, o ciclo da água corresponde ao movimento da água da natureza e, portanto, apresenta os processos de transformação da água.
Em outras palavras, as mudanças dos estados físicos da água ocorrem por meio dos processos denominados: Fusão, Vaporização (Ebulição e Evaporação), Solidificação,Liquefação (Condensação) e Sublimação.
A bússola e o magnetismo
O magnetismo é a capacidade que um objeto possui de atrair outros objetos, e a esses objetos damos o nome de imãs.
Não são apenas os imãs que possuem magnetismo, mas também os objetos que são atraídos por ele. A química pode explicar o fenômeno do magnetismo através das forças dipolo. Por exemplo, os materiais possuem dois diferentes pólos, quando entram em contato com outros materiais os pólos iguais se repelem e os pólos opostos se atraem. Este fenômeno recebe a denominação de “dipolo magnético” e pode ser considerado uma grandeza. A força do imã é determinada por essa grandeza.
Os próprios átomos são considerados imãs com pólos norte e sul. As bússolas trabalham com base no magnetismo, veja o processo de funcionamento:
- O imã se encontra no ponteiro das bússolas, este imã estabelece ao seu redor um campo magnético;
- quando o imã é situado em um campo de outro imã este tende a se alinhar ao campo de referência;
- a Terra possui um campo magnético que funciona como referencial para o funcionamento da bússola.
Não são apenas os imãs que possuem magnetismo, mas também os objetos que são atraídos por ele. A química pode explicar o fenômeno do magnetismo através das forças dipolo. Por exemplo, os materiais possuem dois diferentes pólos, quando entram em contato com outros materiais os pólos iguais se repelem e os pólos opostos se atraem. Este fenômeno recebe a denominação de “dipolo magnético” e pode ser considerado uma grandeza. A força do imã é determinada por essa grandeza.
Os próprios átomos são considerados imãs com pólos norte e sul. As bússolas trabalham com base no magnetismo, veja o processo de funcionamento:
- O imã se encontra no ponteiro das bússolas, este imã estabelece ao seu redor um campo magnético;
- quando o imã é situado em um campo de outro imã este tende a se alinhar ao campo de referência;
- a Terra possui um campo magnético que funciona como referencial para o funcionamento da bússola.
5 descobertas que desafiaram as leis da química
Um dos aspectos mais interessantes da ciência é o fato de que ela é constituída pela incerteza. Tudo aquilo que é considerado uma lei da natureza só permanece como tal enquanto não houver evidências que provem sua ineficácia.
Interpretar o mundo dessa maneira permite que o meio científico realmente avance e,assim, esclareça vários dos mistérios da existência. Afinal, se considerássemos tudo o que sabemos como certo e infalível, de nada adiantaria fazer perguntas que nos levam a novos mistérios e soluções.
Neste artigo, reunimos exemplos de cinco experiências químicas que, embora parecessem impossíveis em um primeiro momento, podem ocorrer quando as condições ideias são alcançadas. Tais descobertas são só alguns exemplos de que vale a pena duvidar de ideais estabelecidas, mesmo que muitas vezes isso não agrade a opinião geral.
Gases nobres reagem com outros elementos
Uma das poucas lembranças conservadas por quem teve aulas de química no ensino médio, mas nunca se interessou muito pelo assunto, é que os gases nobres são os únicos elementos da tabela periódica que nunca reagem com outros. Isso se deve à teoria clássica das ligações químicas, que explica que reações deixam de acontecer a partir do momento em que a camada exterior dos elétrons de uma substância é preenchida.
Essa impossibilidade foi desmentida pelo químico britânico Neil Bartlett, da University of British Columbia, em Vancouver. Em 1961, ele observou que o hexafluoreto de platina (PtF6) era capaz de roubar elétrons do oxigênio, elemento que normalmente provoca a reação contrária — característica que inclusive originou o termo oxidação.
Ao analisar o potencial de ionização (quantidade de energia necessária para mover um elétron) do oxigênio, Batlett percebeu que ele era muito semelhante ao do xenônio, um gás nobre. Como todo bom cientista, ele decidiu misturá-lo ao hexafluoreto de platina: o resultado foi o hexafluoroplatinato de xenônio, XePtF6.
Desde então, diversas reações químicas foram realizadas usando elementos como o criptônio, algumas delas explosivamente instáveis. Situações do tipo mostram que, além de não conhecermos os gases nobres tão bem quanto imaginamos, não é recomendado acreditar em tudo que você ouve na escola.
Existem ligações entre mais de dois elementos
Outra coisa que aprendemos na escola é que o modelo clássico da química só admite reações entre dois elementos, sem que haja espaço para qualquer intruso na história. Essa teoria passou a ser questionada já na década de 1940, por pesquisadores que tentavam explicar certas reações ocorridas em moléculas orgânicas que envolviam a troca de cargas negativas entre grupos pendentes.
Caso uma dessas cargas se perdesse, o fato resultaria na criação de algo conhecido como “carbocátion”, um íon contendo um átomo de carbono com carga positiva. As leis estabelecidas até então diziam que os demais grupos pendentes deveriam se ligar à nova molécula, processo que nem sempre acontecia.
Para explicar a situação, alguns cientistas formularam a tese de que a carga positiva estava formando uma matriz triangular com três átomos de carbono. Essa estrutura não só possibilitava que os grupos pendentes se ligassem a vários locais diferentes, como também permitia que um dos átomos de carbono fizesse cinco ligações, em vez das quatro tradicionais.
Essa tese só pôde ser provada décadas depois, pelo cientista húngaro George Olah, que utilizou espectroscopia nuclear magnética para isolar um carbocátion — feito até então considerado impossível, devido à sua instabilidade. O trabalho não só provou que existem ligações entre três elementos, como rendeu ao pesquisador o prêmio Nobel de química em 1994.
Reações espontâneas podem acontecer em dois sentidos
A Segunda Lei da Termodinâmica afirma que toda espécie de mudança ocorrida no universo é acompanhada pelo aumento da entropia — ou seja, a desordem da existência aumenta constantemente. Assim, todas as reações químicas só trabalhariam em um único sentido, sem a possibilidade de uma volta a seu estado original.
A descoberta do cientista russo Boris Belousov mostrou que isso não era necessariamente verdade. Usando um coquetel de elementos químicos semelhantes à glicose, ele criou uma mistura que alternava entre o amarelo e o incolor de maneira constante — sinal de que a reação estava acontecendo em ambos os sentidos.
Tais oscilações são explicadas pelos compostos intermediários gerados durante o processo, capazes de acelerar suas próprias produções. Combinados a outras misturas capazes de gerar um ciclo que restaurava os componentes usados a seus estados originais, esses agentes explicam os motivos pelos quais o processo acontecia nos dois sentidos.
Eventualmente, os elementos químicos se estabilizavam conforme os compostos intermediários eram consumidos, provando que a situação só ocorre durante reações instáveis. Os fãs da Segunda Lei da Termodinâmica não precisam se preocupar — como ela só abrange reações estáveis, a descoberta não foi capaz de desacreditá-la.
Reações químicas podem acontecer em ambientes frios
A maioria das reações químicas depende de um processo que forma moléculas intermediárias com grande energia que se rearranjam em produtos com menor vigor energético. Para que isso ocorra, geralmente é preciso existir alguma espécie de aquecimento, o que impediria que houvesse qualquer espécie de combinação de elementos no espaço.
Na década de 1970, o químico soviético Vitali Goldanski contestou essa afirmação, provando que certas moléculas envolvidas em reações de polimerização continuavam reagindo mesmo em ambientes com temperaturas próximas a 4 Kelvin (-269° C). O cientista sugeriu que isso acontecia devido a um processo quântico denominado Efeito Túnel, que consiste em uma partícula atravessando uma região em que a energia potencial é maior do que a sua energia total.
Goldanski afirma que é isso que possibilita a ocorrência de reações químicas no espaço, talvez sendo até mesmo o responsável pela formação de moléculas construtoras da vida em grãos interestelares, a partir de ingredientes como cianeto, amônia e água. Mera curiosidade na época de seu descobrimento, o Efeito Túnel é uma das teorias mais bem estabelecidas da química atual.
Simetrias impossíveis
Quando o químico israelita Dan Shechtman afirmou ter descoberto uma forma quasicristalina de simetria atômica em certos sólidos, ele provocou reações bastante contrárias no meio científico. Um de seus principais opositores foi Linus Pauling, cientista famoso por ter chegado próximo de descobrir a estrutura do DNA (ele havia apostado em um formato de três hélices, em vez das duas realmente existentes).
A reação foi tão negativa que ele se viu impedido de continuar suas pesquisas, passando por sérias dificuldades para divulgar seu trabalho. A recompensa veio em 2011, ano em que o pesquisador recebeu um prêmio Nobel por seu trabalho.
A descoberta ocorreu enquanto Shechtman atirava raios de elétrons em ligas metálicas e conferia os padrões resultantes de suas reflexões, o que permitia a ele conferir a forma como os átomos que constituíam os materiais se agrupavam. Entre os resultados, estava uma forma com simetria semelhante a um pentágono, cujos padrões nunca se repetiam de forma exata.
Várias outras ligas quasicristalinas foram descobertas desde então, tanto em polímeros quanto em pedaços de meteoros. Atualmente, há pesquisas que afirmam que até mesmo a água adquire essa característica quando confinada a fendas com espessura extremamente reduzida.
CIENTISTAS CRIAM NOVA FORMA DE OURO
Cientistas da ETH Zurich desenvolveram uma nova forma do ouro que promete revolucionar a maneira como joias e relógios são construídos. A novidade tem peso mil vezes menor que a forma típica do elemento, no entanto é quase impossível diferenciar os dois formatos a olho nu — no entanto, a nova forma é leve o suficiente para sequer abalar a espuma gerada por uma máquina de café.
O time de pesquisadores liderado por Raffaele Mezzenga conseguiu criar uma pepita que é consistida principalmente por poros e que, sob pressão atmosférica, não conduz eletricidade. Isso acontece porque a estrutura atômica da invenção faz com que os átomos de ouro não se toquem em qualquer momento.
 “O chamado aerogel é mil vezes mais leve que as ligas convencionais do ouro. É mais leve que a água e quase mais leve que o ar”, explica Raffaele em um pronunciamento oficial. A espuma é criada a partir do aquecimento de proteínas do leite que são quebradas em fibras de escala nanométrica — o material é misturado a uma solução salina com ouro até que os dois materiais se fundam e criem em uma substância fibrosa com consistência de gel.
“O chamado aerogel é mil vezes mais leve que as ligas convencionais do ouro. É mais leve que a água e quase mais leve que o ar”, explica Raffaele em um pronunciamento oficial. A espuma é criada a partir do aquecimento de proteínas do leite que são quebradas em fibras de escala nanométrica — o material é misturado a uma solução salina com ouro até que os dois materiais se fundam e criem em uma substância fibrosa com consistência de gel.
Várias cores e formatos
Em seguida, o material recebe um banho de dióxido de carbono para chegar a seu formato finalizado. Embora a olho nu a pepita pareça não ser diferente de uma peça de ouro convencional, sua forma pode ser alterada facilmente usando apenas as mãos em um ambiente comum.
 A cor da nova pepita pode ser alterada facilmente mediante a manipulação do tamanho das partículas de ouro utilizadas. “As propriedades óticas do ouro dependem muito do tamanho e da forma de suas partículas”, explica Gustav Nyström, um dos principais contribuintes do estudo. Segundo o time da ETH responsável pela descoberta, o novo material pode ser usado para desenvolver joias assim como para auxiliar na descoberta de novas soluções nos campos da física e da ótica.
A cor da nova pepita pode ser alterada facilmente mediante a manipulação do tamanho das partículas de ouro utilizadas. “As propriedades óticas do ouro dependem muito do tamanho e da forma de suas partículas”, explica Gustav Nyström, um dos principais contribuintes do estudo. Segundo o time da ETH responsável pela descoberta, o novo material pode ser usado para desenvolver joias assim como para auxiliar na descoberta de novas soluções nos campos da física e da ótica.
Ponte de Água
O fenômeno chamado “ponte de água” foi descoberto ainda no século 19 e é uma experiência simples e interessante que pode ser feita em aulas de ciência em uma escola ou mesmo em sua casa: se você pegar água destilada várias vezes, ou seja, o fluido em um estado extremamente puro, colocá-la em dois recipientes próximos um do outro e sujeitar o líquido a altas voltagens, você o verá subindo pelas laterais dos frascos e formando uma ponte de água flutuante que flui para ambos os lados entre os dois.
Estudiosos da Universidade Tecnológica de Graz, na Áustria, redescobriram esse fenômeno em 2007 e recentemente mostraram que esse processo altera o estado da água e dá a ela propriedades exclusivas de densidade e estrutura. Com auxílio da equipe do centro de pesquisa Westus, na Holanda, descobriu-se que essa ponte de água flutuante produz água carregada eletricamente e armazena a carga por pelo menos um curto período.
Como funciona?
A água não é carregada eletronicamente, mas sim “protonicamente”. Nesse fenômeno, o líquido é carregado positiva ou negativamente dependendo se contém mais ou menos prótons. O estudo mostra que, na água anódica (com carga positiva), prótons são formados por causa da eletrólise, gerada pela alta voltagem.
Esses prótons soltos – núcleos do hidrogênio – fluem através da ponte de água para dentro da água catódica do outro recipiente, que tem uma carga negativa, e são neutralizados lá por íons de hidroxila. Como os prótons se movem em uma velocidade finita, sempre há excesso de prótons em um frasco de água e falta deles no outro.
Caso a ponte de água seja quebrada repentinamente, a carga protônica permanece e pode ser medida por espectroscopia de impedância. Os primeiros estudos mostraram que essa carga é capaz de permanecer na água por até uma semana.
Novas possibilidades
A descoberta que mostra que essas pontes de água podem ser utilizadas como reatores eletroquímicos ou bioquímicos abre uma gama de possibilidades de aplicações na indústria. Substâncias podem ser colocadas em contato com outros materiais na ponte de água para sofrerem reações químicas.
Além disso, a água pode se tornar uma bateria, no sentido de armazenar carga elétrica. Assim, ácidos e substâncias alcalinas podem ser produzidos sem nenhum íon opositor, ou seja, sem água ácida ou alcalina. Isso pode abrir caminho para agentes de limpeza ecológicos, para um processo de diminuição da quantidade de dejetos químicos e para novas possibilidades em aplicações médicas.
Assinar:
Comentários (Atom)

